標準業務手順書
倫理審査・管理者許可手続き
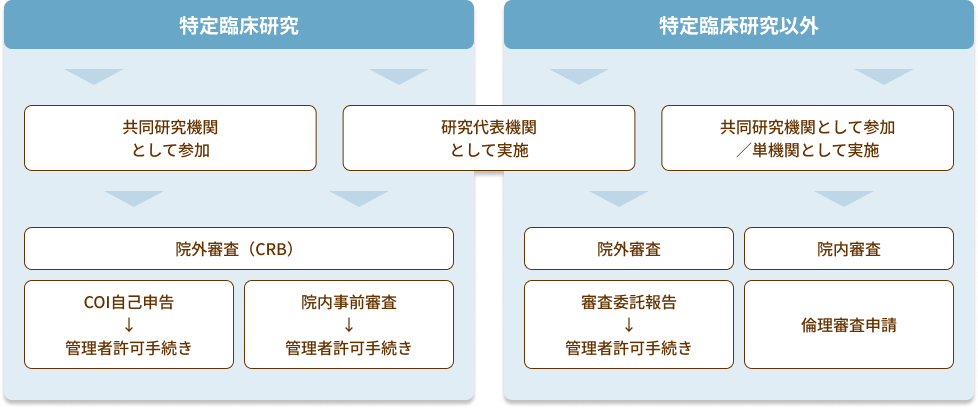
倫理審査・管理者許可手続きの流れは以下図のようになります。実施状況報告や有害事象報告については、院内サイトをご確認ください。
手続きに要する時間の目安
| 手続き | 目安時間 |
|---|---|
| COI自己申告 | 2週間 |
| 審査委託報告 | 1週間 |
| 倫理審査申請 | 通常審査の場合
1.5ヶ月/迅速審査の場合 3週間 ※管理者許可のスケジュールまで含む |
| 管理者許可手続き | 2週間 |
各書類の提出について
※下図は画面に収まらない場合、
左右にスライドしてご覧いただけます。
| 提出先 | 臨床研究管理室 | |
|---|---|---|
| 提出書類 | COI自己申告 |
【特定臨床研究の場合】
臨床研究法 指定様式 ※様式Cまで記入済みのもの
【特定臨床研究以外】
臨床研究に係る利益相反自己申告書(指定様式) |
| 審査委託報告 |
審査委託報告書 研究計画書案など研究の概要がわかる資料 |
|
| 倫理審査申請 |
【新規申請時】
【変更申請時】
|
|
| 管理者許可手続き |
研究倫理審査・実施許可等申請書(指定様式) 審査結果通知書 審査資料一式 実施体制確認書(指定様式) ※多機関共同研究の場合 |
|
倫理審査委員会(臨床研究に関する手続き)について
| 開催スケジュール | |
|---|---|
| 通常審査 | 毎月第4火曜日 ※議案申請〆切は第1火曜日 |
| 迅速審査 | 毎週1回程度 ※不定期 |
| 利益相反確認 | 申請受付時適宜 |
議事録・規程等 厚生労働省サイト:研究倫理審査委員会報告システム(IRB番号:11000964)
コンテンツ
Contents- 学術・研究活動
- 臨床研究に関する手続き
-
公的研究費等の不正使用等防止対策(※準備中)

